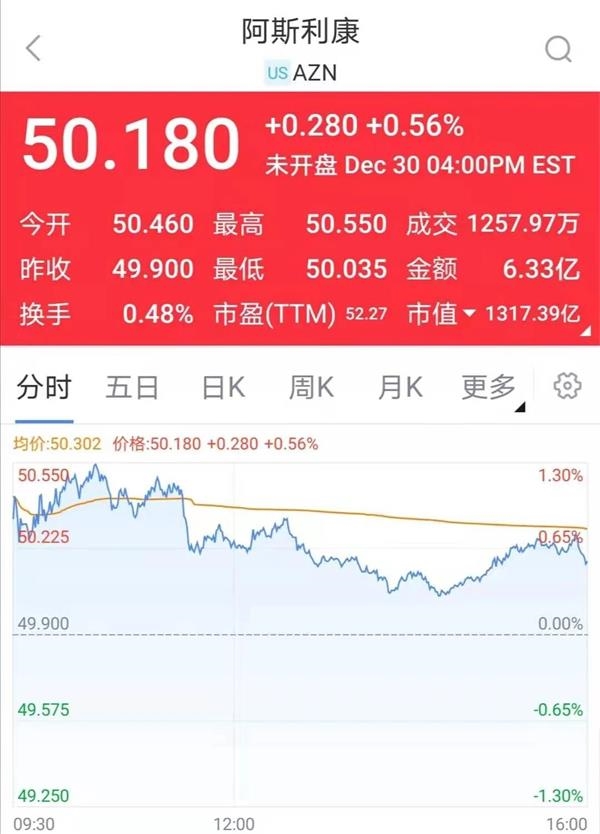
12月30日,欧洲和美国的第三种新型冠状疫苗获得了新的发展。
阿斯利康(AstraZeneca)的官方网站宣布其COVID-19疫苗已获准在英国紧急使用,用于18岁以上的人群。 这是疫苗第一次被批准使用,也是欧美国家批准的第三种紧急使用的新皇冠疫苗。 根据先前公布的III期临床数据,两次疫苗接种后14天,有症状COVID-19的发生率为70.4%。
消息一出,阿斯利康的股价就一度上涨了近2%。 截至收盘,它回落并上涨了0.56%。

但是,值得注意的是,这种有争议的疫苗尚未得到欧盟的批准。 欧洲药品管理局(EMA)表示,为了进一步确定疫苗的安全性和预防能力,需要更多数据才能做出批准决定。
01
阿斯利康的新皇冠疫苗已获批准在英国紧急使用
根据《 21世纪经济报道》,英国药品和保健产品监管局(MHRA)已授权紧急使用阿斯利康的COVID-19疫苗AZD1222进行18岁及以上人群的主动免疫。 建议将疫苗注射两次,间隔4至12周。 临床试验表明,该程序可以有效预防有症状COVID-19的感染。 第二次给药后超过14天没有严重病例或住院病例。
该疫苗是由牛津大学及其衍生公司Vaccitech共同开发的。 它使用基于普通感冒病毒(腺病毒)弱化版本的复制缺陷型黑猩猩病毒载体,该病毒会导致黑猩猩感染,并包含SARS-CoV-2病毒刺突蛋白的遗传物质。 接种疫苗后,将产生表面刺突蛋白。 如果以后感染人体,它将刺激免疫系统攻击SARS-CoV-2病毒。
阿斯利康正在与MHRA,英国疫苗接种和免疫联合委员会以及公共卫生部和英国国家卫生服务局合作,在英国部署和推广该疫苗。 该公司计划在2021年第一季度提供数百万剂疫苗,这是与政府达成的协议的一部分,根据该协议,阿斯利康将向英国提供总计1亿剂疫苗。
英国政府表示AZD1222疫苗将优先给予易感人群,并将于下周一开始注射。
阿斯利康(AstraZeneca)首席执行官Pascal Soriot说:“今天对于英国数百万可以使用这种新疫苗的人们来说是重要的一天。 已经证明它是有效的,耐受性良好且易于管理的。 Sleeca是免费的。 我们要感谢阿斯利康,牛津大学,英国政府的许多同事以及数千名临床试验参与者。”
MHRA的批准决定基于其人类医学委员会在对试验数据进行滚动审核后的独立建议,其中包括对牛津大学领导的III期计划的中期分析。 数据于2020年12月8日发表在《柳叶刀》上。
疫苗的其他安全性和有效性数据将从正在进行的临床试验中继续积累。 阿斯利康将继续与世界各地的监管机构合作,以支持他们在健康危机期间对应急物资或有条件的市场许可进行连续滚动审查。 阿斯利康还正在寻求世界卫生组织的紧急使用清单,以加快中低收入国家疫苗的获取。
阿斯利康表示,预计到2021年将在全球生产约30亿剂疫苗。该疫苗可以在正常冷藏条件(28摄氏度/ 36-46华氏度)下存储和运输至少六个月,并且可以在现有的环境中使用医疗机构。
02
欧盟失败
值得注意的是,这种有争议的疫苗尚未得到欧盟的批准。
根据国外媒体12月31日的最新报道,阿斯利康公司在获得该国的批准后表示,该公司已向欧洲药品管理局(EMA)申请在当地紧急使用该疫苗,并且已将所有疫苗临床试用数据全部已提交。
EMA回应称,该机构已于12月21日收到阿斯利康疫苗的三项清晰的测试数据,目前正在评估这些数据。 但是,他们认为,为了进一步确定疫苗的安全性和预防能力,在做出批准决定之前仍需要更多数据。
换句话说,欧洲药品管理局认为阿斯利康疫苗的最新测试数据不足以证明其安全性和有效性。因此,阿斯利康可能需要重启测试以提供更多数据,以通过欧盟批准。
据国外媒体援引参与英国疫苗批准的官员穆尼尔·皮尔穆罕默德的话说,当两次注射间隔三个月时,阿斯利康疫苗的有效率可高达80%。 但是,没有足够的证据支持一次注射的疫苗接种方法。 另一位参与疫苗批准的英国医生魏慎林(Wei Shen Lim)也透露,在第一剂疫苗后第二天到第二剂之前21天,有效率约为70%。
03
数据中是否存在“重大漏洞”?
实际上,在阿斯利康疫苗公开了第三阶段试验的数据后,科学家对此提出了质疑。 根据12月10日中央电视台新闻报道,11月23日宣布的疫苗有效率为70.4%,是通过结合两组测试数据获得的。 在针对8895人的2剂量方案试验中,该疫苗的有效率仅为62%; 在2 741人的1.5剂量方案中,有效率高达90%。
一些专家怀疑阿斯利康的疫苗数据存在“重大漏洞”。他们认为,小样本量试验的有效率为90%,使得很难解释该有效率是真实结果还是偶然偏差结果。 此外,一些关键数据缺乏透明度。
12月8日,阿斯利康在“柳叶刀”上宣布了该新皇冠疫苗的III期临床试验的中期分析结果。 数据显示,受试者接受两种标准剂量的疫苗后,有效率为62%,显着低于Pfizer / BioNTech和Moderna’s mRNA疫苗。 在低剂量然后是标准剂量的疫苗后,有效性高达90%,显示出明显的保护功效。
据了解,阿斯利康(AstraZeneca)透露,在III期临床试验前,一些受试者在接种疫苗时犯了错误。 3000名受试者仅接受第一剂疫苗的一半剂量。 正是这3000名受试者的试验有效率为90%。
当时,有媒体称其为“美丽的错误”,但尽管结果很漂亮,但人类临床试验中的错误也受到批评。 毕竟,这两种剂量方案的测试结果是不同的,所以越来越多的人对该疫苗的临床试验数据产生怀疑。
另外,疫苗受试者的年龄不超过55岁。 一般来说,老年人容易感染新的冠状病毒,免疫反应较慢。 这项研究的结果令人怀疑该疫苗是否可以承受进一步的测试。
目前,AZD1222正在美国进行40,000人的临床试验。 阿斯利康(AstraZeneca)首席执行官Pascal Soriot说,要获得FDA批准,需要在美国提供临床数据。 牛津大学疫苗学教授莎拉·吉尔伯特(Sarah Gilbert)也说:“临床试验的结果取决于试验的进展,研究人员不确定何时可以在美国获得临床数据。”
另外,AZD1222的标准剂量方案还不够好。 在英国的临床试验中,接受两种标准剂量的患者的有效性为62%,但置信区间的下限为28%,低于FDA的30%标准。 这是FDA在不久的将来不批准AZD1222的原因之一。
值得一提的是,今年9月初,一名英国志愿者在接种AZD1222疫苗后发生了不良反应。 阿斯利康暂停了全球临床试验。 今年10月,FDA审查了该疫苗的数据,并认为它是安全的,并被授权恢复该测试。
尽管AZD1222已在英国获得批准,但要通过欧盟更加困难。 在这方面,阿斯利康(AstraZeneca)暗示可能会重启该试验,并针对该疫苗展开另一轮第三阶段试验,以验证1.5剂量方案的最终效率。为了获得欧盟的批准,英国公司重启测试的可能性非常高。
据统计,由于对阿斯利康的早期乐观态度,阿斯利康已经收到了超过20亿剂的疫苗预订单。 它是第一家与欧盟签订合同的公司。 合同的总剂量为3亿剂,可以选择增加1亿剂。
到目前为止,只有辉瑞/ BioNTech被EMA批准用于这种新的冠状疫苗。 根据EMA的官方网站,Moderna的疫苗将于2021年1月6日举行会议,以评估疫苗的有效性,如有必要,另一次会议将于1月12日举行。

(编辑:段靖远)
关键字: